Гидролиз органических. Гидролиз органических соединений
Реакция обменного разложения веществ водой называется гидролизом. Такому воздействию подвергаются неорганические и органические вещества - соли, углеводы, галогеналканы, белки, сложные эфиры. Процесс протекает обратимо и необратимо.
Неорганические вещества
Среди неорганических соединений гидролизу подвергаются растворимые минеральные соли за счёт взаимодействия ионов с молекулами воды. В результате соль распадается на катионы и анионы, то есть образуется электролит.

Рис. 1. Классификация солей по растворимости.
Соли могут быть образованы:
- слабой кислотой и сильным основанием (Na 2 CO 3);
- сильной кислотой и слабым основанием (ZnSO 4);
- слабой кислотой и слабым основанием (Fe 2 (CO 3) 3);
- сильной кислотой и сильным основанием (Na 2 SO 4).
Ионы соли при гидролизе способны образовывать с Н + и ОН – слабые электролиты. В зависимости от связи с ионами воды выделяют реакции, протекающие по катиону или аниону, а также по катиону и аниону.
Гидролизу не подвергаются соли, состоящие из сильной кислоты и сильного основания.
Описание процесса для разных солей представлено в таблице.
|
Гидролиз |
Соль |
Описание |
|
По аниону |
Слабая кислота, сильное основание |
Протекает ступенчато. Образуется слабощелочная среда. Реакция обратима. Анионы соли связываются с катионом воды: 1. Na 2 CO 3 + H 2 O ↔ NaHCO 3 + NaOH; 2. NaHCO 3 + HOH ↔ H 2 CO 3 + NaOH |
|
По катиону |
Сильная кислота, слабое основание |
Протекает ступенчато, по второй и третье ступени - незначительно. Образуется слабокислая среда. Реакция обратима. Катионы соли связываются с анионом воды: NH 4 Cl + H 2 O ↔ NH 4 OH + HCl |
|
По аниону и катиону |
Слабая кислота, слабое основание |
Протекает полностью. Смещение равновесия в сторону конечных продуктов. Среда зависит от констант диссоциации. Реакция необратима: Al 2 S 3 + 6H 2 O → 2Al(OH) 3 ↓ + 3H 2 S |

Рис. 2. Схема гидролиза соли.
Обратимый процесс подчиняется принципу Ле Шателье: скорость реакции увеличивается при добавлении воды (разведении раствора) или повышении температуры.
Органические вещества
Водному разложению подвергаются высокомолекулярные вещества. В результате гидролиза образуются мономеры или происходит разрыв связей между углеродом и заместителями. Для осуществления реакции необходимы дополнительные условия.
Краткое описание разложение под действием воды органических веществ описано в таблице.
|
Вещество |
Описание |
Уравнение |
|
Галогеналканы |
Протекает в щелочной среде. Образуются спирты |
C 5 H 11 Cl + H 2 O (NaOH) → C 5 H 11 OH |
|
Сложные эфиры |
Образуются карбоновые кислоты и спирты |
CH 3 COOCH 3 + H 2 O ↔ CH 3 COOH + CH 3 OH |
|
Алкоголяты |
Образуются спирт и щёлочь |
C 2 H 5 ONa + H 2 O ↔ C 2 H 5 OH + NaOH |
|
Углеводы |
Подвергаются олигосахариды и полисахариды. Образуются моносахариды |
C 12 H 22 O 11 (сахароза) + H 2 O → C 6 H 12 O 6 (глюкоза) + C 6 H 12 O 6 (фруктоза) |
|
Частично разлагаются. Образуются аминокислоты |
CH 2 (NH 2)-CO-NH-CH 2 -COOH + H 2 O ↔ 2CH 2 (NH 2)-COOH |
|
|
Протекает при нагревании под действием кислот и щелочей. Образуются глицерин и соли карбоновых кислот |
(C 17 H 35 COO) 3 C 3 H 5 + H 2 O → C 3 H 8 O 3 + 3C 17 H 35 COONa |
Нуклеиновые кислоты гидролизуются поэтапно. Изначально образуются нуклеотиды, которые также подвергаются гидролизу. Конечные продукты - моносахариды и ортофосфорная кислота

Рис. 3. Схема гидролиза нуклеиновых кислот.
Что мы узнали?
Из темы урока химии 11 класса узнали, что гидролиз - процесс разложения веществ под действием воды. Реакции подвергаются соли, сложные эфиры, галогеналканы, алкоголяты, белки, жиры, углеводы. Процесс зачастую протекает ступенчато. В зависимости от конечных продуктов гидролиз протекает обратимо и необратимо. Ускорить взаимодействие веществ с водой и добиться полного разложения можно добавлением воды или повышением температуры.
Тест по теме
Оценка доклада
Средняя оценка: 4.7 . Всего получено оценок: 110.
Цели урока: На основе универсального понятия “ гидролиз” показать единство мира органических и неорганических веществ. Используя интеграционный потенциал этого понятия раскрыть внутри – и межпредметные связи химии, дать яркое представление о практической значении процессов гидролиза в живой и неживой природе и в жизни общества. Ознакомить учащихся с сущностью гидролиза солей и научить составлять уравнения гидролиза различных солей.
Оборудование и реактивы: Растворы HCI, HNO 3 , NaOH, Na 2 CO 3 , AICI 3 , KNO 3 , FeCI 3 ; кусочек CaC 2 ; пробирки, штативы, растворы индикаторов и наборы универсальной индикаторной бумаги.
Форма урока. Лекция.
Ход урока
1. Организационный момент.
2. Объяснение нового материла (в ходе объяснения материла, идет демонстрация опытов).
Гидролиз – реакция обменного разложения веществ водой.
Гидролизу подвергаются: органические и неорганические вещества .
Реакции гидролиза могут быть: обратимые и необратимые.
- Гидролиз органических веществ :
А) гидролиз галогеналканов: C 2 H 5 CI + H 2 O
-> C 2 H 5 OH + HCI
Б) гидролиз сложных эфиров: CH 3 COOC 2 H 5
+ H 2 O -> CH 3 COOH + C 2 H 5 OH
В) гидролиз жиров:
Г) гидролиз дисахаридов: C 12 H 22 O 11
+ H 2 O ->C 6 H 12 O 6 + C 6 H 12 O 6
Д) гидролиз белков:
H 2 N – CH 2 – CO – NH – CH 2 – CO – NH – CH 2 – COOH + H 2 O-> 3H 2 N – CH 2 COOH
Е) гидролиз полисахаридов: (C 6 H 10 O 5) n + H 2 O -> n C 6 H 12 O 6
Приложение 1 )
2. Гидролиз бинарных неорганических веществ :
А) гидролиз карбидов: CaC 2 + 2H 2 O -> Ca(OH) 2
+ C 2 H 2
Б) гидролиз галогенидов: SiCI 4 + 3 H 2 O -> H 2 SiO 4
+ 4 HCI
В) гидролиз гидридов: NaH + H 2 O ->NaOH + H 2
Г) гидролиз фосфидов: Mq 3 P 2 + 6H 2 O
->3 Mq(OH) 2 + 2PH 3
Д) гидролиз сульфидов: AI 2 S 3 + 6H 2 O
->2AI(OH) 3 + 3 H 2 S.
При растворении некоторых солей в воде самопроизвольно протекают не только диссоциация их на ионы и гидратация ионов, но и процесс гидролиза солей.
Гидролиз солей – это протолитический процесс взаимодействия ионов солей с молекулами воды, в результате которого образуются малодиссоциирующие молекулы или ионы.
С позиции протолитической теории гидролиз ионов солей заключается в переходе протона от молекулы воды к аниону соли или катиону соли (с учетом его гидратации) к молекуле воды. Таким образом, в зависимости от природы иона вода выступает либо как кислота, либо как основание, а ионы соли при этом являются соответственно сопряженным основанием или сопряженной кислотой.(в водном растворе соли появляется избыток свободных H + илиOH – и раствор соли становится кислотным или щелочным.
Возможны три варианта гидролиза ионов солей:
- гидролиз по аниону – соли, содержащий катион сильного основания и анион слабой кислоты;
- гидролиз по катиону – соли, содержащие катион слабого основания и анион сильной кислоты;
- гидролиз и по катиону, и по аниону – соли, содержащие катион слабого основания и анион слабой кислоты.
Рассмотрим случаи гидролиза
Гидролиз по аниону. Соли, содержащие анионы слабых кислот, например ацетаты, цианиды, карбонаты, сульфиды, взаимодействуют с водой, так как эти анионы являются сопряженными основаниями, способными конкурировать с водой за протон, связывая его в слабую кислоту:
A - + H 2 O -> AH + OH – pH > 7 |
|
| CH 3 COO – + H 2 O ->CH 3 COOH + OH – | CN – + H 2 O -> HCN + OH - |
| CO 3 2– + H 2 O -> HCO 3 – + OH – | HCO 3 – + H 2 O ->H 2 CO 3 + OH - |
| I ступень | II ступень |
При этом взаимодействии возрастает концентрация ионов OH - , и поэтому pH водных растворов солей, гидролизующихся по аниону, всегда находится в щелочной областиpH > 7. Гидролиз многозарядных анионов слабых кислот в основном протекает по I ступени. Работа обучающихся по листу заданий (Приложение 2 )
Для характеристики состояния равновесия при гидролизе солей используют константу гидролиза К г, которая при гидролизе по аниону равна:

где К H2O – ионное произведение воды; К а – константа диссоциации слабой кислоты НА.
В соответствии с принципом Ле – Шателье смещения химического равновесия для подавления гидролиза, протекающего по аниону, к раствору соли следует добавить щелочь как поставщика иона ОН - , образующегося при гидролизе соли по аниону (ион, одноименный продукту гидролиза).
Гидролиз по катиону. Соли, содержащие катионы слабых оснований, например катионы аммония, алюминия, железа, цинка, взаимодействуют с водой, так как являются сопряженными кислотами, способными отдавать протон молекулам воды или связывать ионы ОН – молекул воды с образованием слабого основания:
Kt + + H 2 O -> KtOH + H + pH < 7
NH 4 + + H 2 O -> NH 3 + H 3 O +
Fe 3+ + H 2 O -> FeOH 2+ + H + ; I – ступень
FeOH 2+ + H 2 O -> Fe(OH) + 2 + H + ; II – ступень
Fe(OH) + 2 + H 2 O ->Fe(OH) 3 + H + III – ступень
При этом взаимодействии возрастает концентрация ионов H + , и поэтому pH водных растворов солей, гидролизующихся по катиону, всегда находится в кислой областиpH < 7. Гидролиз многозарядных катионов слабых оснований в основном протекает по I ступени.
Для подавления гидролиза, протекающего по катиону, к раствору соли следует добавить кислоту как поставщика иона Н + , образующегося при гидролизе соли по катиону (ион, одноименный продукту гидролиза. Работа обучающихся по листу заданий (Приложение 2 )
Гидролиз по катиону и по аниону. В этом случае в реакции гидролитического взаимодействия с водой участвуют одновременно и катионы, и анионы, а реакция среды определяется природой сильного электролита.
Если гидролиз по катиону и по аниону протекает в равной степени (кислота и основание – одинаково слабые электролиты), то раствор соли имеет нейтральную реакцию; например, водный раствор ацетата аммония NH 4 CH 3 COO имеет pH = 7,т.к.pK a (CH 3 COOH) = 4,76 и pK b (NH 3 *H 2 O) = 4,76.
Если в растворе преобладает гидролиз по катиону (основание слабее кислоты), раствор такой соли имеет слабокислую реакцию (pH < 7) , например нитрит аммония NH 4 NO 2
(pK a (HNO 2) = 3,29) .
Если в растворе преобладает гидролиз по аниону (кислота слабее основания), раствор такой соли имеет слабощелочную реакцию (pH > 7) , например цианид аммония NH4СN
(pK a (HСN) = 9,31) .
Работа обучающихся по листу заданий (Приложение 2 )
Некоторые соли, гидролизующиеся по катиону и по аниону, например сульфиды или карбонаты алюминия, хрома, железа (III), гидролизуются полностью и необратимо, так как при взаимодействии их ионов с водой образуются малорастворимые основания и летучие кислоты, что способствует протеканию реакции до конца:
AI 2 (CO 3) 3 + 3 H 2 O ->2 AI(OH) 3 + 3 CO 2 ; Cr 2 S 3 + 6 H 2 O ->2 Cr(OH) 3 + 3 H 2 S
Механизм необратимого гидролиза
В растворах двух солей, например сульфида натрия (Na 2 S) и хлорида алюминия (AICI 3), взятых порознь, устанавливается равновесие: S 2– + H 2 O -> HS – + OH -
AI 3+ + H 2 O -> AIOH 2+ + H +
гидролиз ограничивается I стадией. При смешивании этих растворов, ионы Н + и ОН – взаимно нейтрализуют друг друга, уход этих ионов из сферы реакции в виде малодиссоциированной воды смещает оба равновесия вправо и активизирует последующие ступени гидролиза:
HS – + H 2 O -> H 2 S + ОН –
AIOH 2+ + H 2 O -> AI(OH) + 2 + Н +
AI(OH) + 2 + H 2 O -> AI(OH) 3 + Н + ,
что в конечном счете приводит к образованию слабого основания и слабой кислоты.
2AICI 3 + 3 Na 2 S + 6 H 2 O -> 2 AI(OH) 3 + 3 H 2 S + 6 NaCI
Эту особенность гидролиза подобных солей следует обязательно учитывать при сливании сточных вод, чтобы избежать их вспенивания за счет образования CO 2 или отравления окружающей среды сероводородом.
Степень гидролиза (h ) – количественная характеристика гидролиза.
h = n / N * 100% ,
Степень гидролиза равна отношению числа гидролизованных молекул соли к общему числу растворенных молекул. зависит:
А) температуры, Б) концентрации раствора, В) тип соли (природы основания, природы кислоты).
Факторы, влияющие на степень гидролиза:
Глубина протекания гидролиза солей в значительной степени зависит и от внешних факторов, в частности от температуры и концентрации раствора . При кипячении растворов гидролиз солей протекает значительно глубже, а охлаждение растворов, наоборот, уменьшает способность соли подвергаться гидролизу.
Увеличение концентрации большинства солей в растворах также уменьшает гидролиз, а разбавление растворов заметно усиливает гидролиз солей.
Гидролиз – процесс эндотермический, в большинстве обратимый. В соответствии с принципом смещения химического равновесия для подавления гидролиза – следует понизить температуру, увеличить концентрацию исходной соли, ввести в раствор один из продуктов гидролиза(кислоты – Н + , щелочи – ОН -); для усиления гидролиза – следует повысить температуру, разбавить раствор, связывание какого – либо продукта гидролиза (Н + или ОН -) в молекулы слабого электролита H 2 O
Значение гидролиза
- Гидролитические процессы вместе с процессами растворения играют важную роль в обмене веществ. С ними связано поддержание на определенном уровне кислотности крови и других физиологических жидкостей. Действие многих химиотерапевтических средств связано с их кислотно – основными свойствами и склонностью к гидролизу.
- Геохимические процессы.
- Химическая промышленность
1). Гидролиз эндотермическая реакция, поэтому повышение температуры усиливает гидролиз.
2). Повышение концентрации ионов водорода ослабляет гидролиз, в случае гидролиза по катиону. Аналогично, повышение концентрации гидроксид-ионов ослабляет гидролиз, в случае гидролиза по аниону.
3). При разбавлении водой равновесие смещается в сторону протекания реакции, т.е. вправо, степень гидролиза возрастает.
4). Добавки посторонних веществ могут влиять на положение равновесия в том случае, когда эти вещества реагируют с одним из участников реакции. Так, при добавлении к раствору сульфата меди
2CuSO4 + 2H2O <=> (CuOH)2SO4 + H2SO4
раствора гидроксида натрия, содержащиеся в нем гидроксид-ионы будут взаимодействовать с ионами водорода. В результате их концентрация уменьшится, и, по принципу Ле Шателье, равновесие в системе сместится вправо, степень гидролиза возрастет. А если к тому же раствору добавить раствор сульфида натрия, то равновесие сместится не вправо, как можно было бы ожидать (взаимное усиление гидролиза) а наоборот, влево, из-за связывания ионов меди в практически нерастворимый сульфид меди.
5). Концентрация соли. Рассмотрение этого фактора приводит к парадоксальному выводу: равновесие в системе смещается вправо, в соответствии с принципом Ле Шателье, но степень гидролиза уменьшается.
Пример,
Al(NO 3 ) 3
Соль гидролизуется по катиону. Усилить гидролиз этой соли можно, если:
- нагреть или разбавить раствор водой;
- добавит раствор щёлочи (NaOH);
- добавить раствор соли, гидролизующейся по аниону Nа 2 СО 3 ;
- растворение вести на холоду;
- готовить как можно более концентрированный раствор Al(NO 3 ) 3 ;
- добавить к раствору кислоту, например HCl
Гидролиз солей многокислотных оснований и многоосновных кислот проходит ступенчато
Например, гидролиз хлорида железа (II) включает две ступени:
1-ая ступень
FeCl 2 + HOH <=>Fe(OH)Cl + HCl
Fe
2+
+ 2Cl - + H + + OH - <=>Fe(OH) + + 2Cl - + H +
2-ая ступень
Fe(OH)Cl + HOH <=>Fe(OH) 2 + HCl
Fe(OH) + + Cl - + H + + OH - <=>Fe(ОН) 2 +
Н +
+ Cl -
Гидролиз карбоната натрия включает две ступени:
1-ая ступень
Nа 2 СО 3 + HOH <=>NаНСО 3 + NаОН
СО 3 2- + 2Na + + H + + OH - =>НСО 3 - + ОН - + 2Na +
2-ая ступень
NаНСО 3 + Н 2 О <=>NаОН + Н 2 СО 3
НСО 3 - + Na + + H + + OH - <=>Н 2 СО 3 + ОН - + Na +
Гидролиз - процесс обратимый. Повышение концентрации ионов водорода и гидроксид-ионов препятствует протеканию реакции до конца. Параллельно с гидролизом проходит реакция нейтрализации, когда образующееся слабое основание (Fe(ОН) 2) взаимодействует с сильной кислотой, а образующаяся слабая кислота (Н 2 СО 3) - со щелочью.
Гидролиз протекает необратимо, если в результате реакции образуется нерастворимое основание и (или) летучая кислота:
Al 2 S 3 + 6H 2 O =>2Al(OH) 3 ↓+ 3H 2 S
Cоли, полностью разлагаемые водой - Al 2 S 3 , нельзя получить по реакции обмена в водных растворах, так как вместо обмена протекает реакция совместного гидролиза:
2AlCl 3 +3Na 2 S≠Al 2 S 3 +6NaCl
2AlCl 3 +3Na 2 S+6H 2 O=2Al(OH) 3 ↓+6NaCl+3H 2 S (взаимное усиление гидролиза)
Поэтому их получают в безводных средах спеканием или другими способами, например:
2Al+3S = t ° C =Al 2 S 3
Примеры реакций гидролиза
(NH 4) 2 CO 3 карбонат аммония – соль, слабой кислоты и слабого основания. Растворима. Гидролизуется по катиону и аниону одновременно. Число ступеней – 2.
1 ступень: (NH 4) 2 CO 3 +H 2 O ↔ NH 4 OH+NH 4 HCO 3
2 ступень: NH 4 HCO 3 +H 2 O ↔NH 4 OH +H 2 CO 3
Реакция раствора слабощелочная pH >7, т.к гидроксид аммония более сильный электролит, чем угольная кислота. К д (NH 4 OH )>К д (H 2 CO 3)
CH 3 COONH 4 ацетат аммония – соль, слабой кислоты и слабого основания. Растворима. Гидролизуется по катиону и аниону одновременно. Число ступеней – 1.
CH 3 COONH 4 +H 2 O ↔NH 4 OH +СH 3 COOH
Реакция раствора нейтральная pH =7, т.к К д (CH 3 COO Н)=К д (NH 4 OH )
K 2 HPO 4 – гидроортофосфат калия - соль, слабой кислоты и сильного основания. Растворима. Гидролизуется по аниону. Число ступеней – 2.
1 ступень: K 2 HPO 4 +H 2 O ↔KH 2 PO 4 +KOH
2 ступень: KH 2 PO 4 +H 2 O ↔H 3 PO 4 +KOH
Реакция раствора 1 ступени слабощелочная pH =8,9 , так как в результате гидролиза в растворе накапливаются ионы OH - и процесс гидролиза преобладает над процессом диссоциации ионов HPO 4 2- , дающим ионы H + (HPO 4 2- ↔H + +PO 4 3-)
Реакция раствора 2 ступени слабокислая pH =6,4 , так как процесс диссоциации дигидроортофосфат ионов преобладает над процессом гидролиза, при этом ионы водорода не только нейтрализуют гидроксид-ионы, но и остаются в избытке, что и обуславливает слабокислую реакцию среды.
Задача: Определите среду растворов гидрокарбоната и гидросульфита натрия.
Решение:
1) Рассмотрим процессы в растворе гидрокарбоната натрия. Диссоцияция этой соли идёт в две ступени, катионы водорода образуются на второй ступени:
NaHCO 3 = Na + + HCO 3 - (I)
HCO 3 - ↔ H + + CO 3 2- (II )
Константа диссоциации по второй ступени - это К 2 угольной кислоты, равная 4,8∙10 -11 .
Гидролиз гидрокарбоната натрия описывается уравнением:
NaHCO 3 +H 2 O ↔ H 2 CO 3 +NaOH
HCO 3 - +H 2 O ↔H 2 CO 3 +OH - , константа которого равна
K г =K w /K 1 (H 2 CO 3)=1∙10 -14 /4,5∙10 -7 =2,2∙10 -8 .
Константа гидролиза заметно больше константы диссоциации, поэтому раствор NaHCO 3 имеет щелочную среду .
2) Рассмотрим процессы в растворе гидросульфита натрия. Диссоцияция этой соли идёт в две ступени, катионы водорода образуются на второй ступени:
NaHSO 3 = Na + + HSO 3 - (I)
HSO 3 - ↔ H + + SO 3 2- (II)
Константа диссоциации по второй ступени - это К 2 сернистой кислоты, равная 6,2∙10 -8 .
Гидролиз гидросульфита натрия описывается уравнением:
NaHSO 3 +H 2 O ↔H 2 SO 3 +NaOH
HSO 3 - +H 2 O ↔H 2 SO 3 +OH - , константа которого равна
K г =K w /K 1 (H 2 SO 3)=1∙10 -14 /1,7∙10 -2 =5,9∙10 -13 .
В этом случае костанта диссоциации больше константы гидролиза, поэтому раствор
NaHSO 3 имеет кислую среду .
Задача: Определить среду раствора соли цианида аммония.
Решение:
NH 4 CN ↔NH 4 + + CN –
NH 4 + + 2H 2 O ↔NH 3 . H 2 O + H 3 O +
CN – + H 2 O ↔HCN + OH –
NH 4 CN +H 2 O ↔ NH 4 OH + HCN
К д (HCN) =7.2∙10 -10 ; К д (NH 4 OH) =1.8∙10 -5
Ответ: Гидролиз по катиону и аниону, т.к. K o > K к, слабощелочная среда, pH > 7
Гидролизомназывают
реакции
обменного
взаимодействия
вещества с водой, приводящие к их
разложению.
Особенности
Гидролиз органическихвеществ
Живые организмы осуществляют
гидролиз различных органических
веществ в ходе реакций при
участии ФЕРМЕНТОВ.
Например, в ходе гидролиза при
участии пищеварительных
ферментов БЕЛКИ расщепляются
на АМИНОКИСЛОТЫ,
ЖИРЫ - на ГЛИЦЕРИН и
ЖИРНЫЕ КИСЛОТЫ,
ПОЛИСАХАРИДЫ (например,
крахмал и целлюлоза) - на
МОНОСАХАРИДЫ (например, на
ГЛЮКОЗУ), НУКЛЕИНОВЫЕ
КИСЛОТЫ - на свободные
НУКЛЕОТИДЫ.
При гидролизе жиров в
присутствии щёлочей
получают мыло; гидролиз
жиров в присутствии
катализаторов применяется
для получения глицерина и
жирных кислот. Гидролизом
древесины получают этанол, а
продукты гидролиза торфа
находят применение в
производстве кормовых
дрожжей, воска, удобрений и
др.
Гидролиз органических соединений
жиры гидролизуются с получением глицерина икарбоновых кислот (с NaOH – омыление).
крахмал и целлюлоза гидролизуются до
глюкозы:
Обратимый и необратимый гидролиз
Почти все реакции гидролизаорганических веществ
обратимы. Но есть и
необратимый гидролиз.
Общее свойство необратимого
гидролиза - один (лучше оба)
из продуктов гидролиза должен
быть удален из сферы реакции
в виде:
- ОСАДКА,
- ГАЗА.
СаС₂ + 2Н₂О = Са(ОН)₂↓ + С₂Н₂
При гидролизе солей:
Al₄C₃ + 12 H₂O = 4 Al(OH)₃↓ + 3CH₄
Al₂S₃ + 6 H₂O = 2 Al(OH)₃↓ + 3 H₂S
CaH₂ + 2 H₂O = 2Ca(OH)₂↓ + H₂
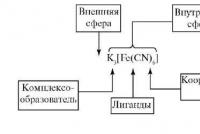
Г И Д Р О Л И З С О Л Е Й
ГИДРОЛИЗ СОЛЕЙГидролиз солей -
разновидность реакций
гидролиза, обусловленного
протеканием реакций
ионного обмена в растворах
(водных) растворимых
солей-электролитов.
Движущей силой процесса
является взаимодействие
ионов с водой, приводящее к
образованию слабого
электролита в ионном или
молекулярном виде
(«связывание ионов»).
Различают обратимый и
необратимый гидролиз солей.
1. Гидролиз соли слабой
кислоты и сильного основания
(гидролиз по аниону).
2. Гидролиз соли сильной
кислоты и слабого основания
(гидролиз по катиону).
3. Гидролиз соли слабой
кислоты и слабого основания
(необратимый).
Соль сильной кислоты и
сильного основания не
подвергается гидролизу.
Уравнения реакций
Гидролиз соли слабой кислоты и сильного основания(гидролиз по аниону):
(раствор имеет щелочную среду, реакция протекает
обратимо, гидролиз по второй ступени протекает в
ничтожной степени).
Гидролиз соли сильной кислоты и слабого основания
(гидролиз по катиону):
(раствор имеет кислую среду, реакция протекает обратимо,
гидролиз по второй ступени протекает в ничтожной
степени).
10.
Гидролиз соли слабой кислоты и слабого основания:(равновесие смещено в сторону продуктов, гидролиз
протекает практически полностью, так как оба продукта
реакции уходят из зоны реакции в виде осадка или
газа).
Соль сильной кислоты и сильного основания не
подвергает- ся гидролизу, и раствор нейтрален.
11. СХЕМА ГИДРОЛИЗА КАРБОНАТА НАТРИЯ
Na₂CO₃NaOH
сильное основание
H₂CO₃
слабая кислота
ЩЕЛОЧНАЯ СРЕДА
СОЛЬ КИСЛАЯ, гидролиз по
АНИОНУ
12. СХЕМА ГИДРОЛИЗА ХЛОРИДА МЕДИ (II)
CuCl₂Cu(OH)₂↓
слабое основание
HCl
сильная кислота
КИСЛАЯ СРЕДА
СОЛЬ ОСНОВНАЯ, гидролиз по
КАТИОНУ
13. СХЕМА ГИДРОЛИЗА СУЛЬФИДА АЛЮМИНИЯ
Al₂S₃Al(OH)₃↓
слабое основание
H₂S
слабая кислота
НЕЙТРАЛЬНАЯ РЕАКЦИЯ
СРЕДЫ
гидролиз необратимый
14.
РОЛЬ ГИДРОЛИЗА В ПРИРОДЕПреобразование земной коры
Обеспечение слабощелочной среды морской
воды
РОЛЬ ГИДРОЛИЗА В ЖИЗНИ
ЧЕЛОВЕКА
Стирка
Мытье посуды
Умывание с мылом
Процессы пищеварения